Sci Adv|血液内科肖浩文团队研究发现肿瘤相关蛋白PTPN21的结构和机制
蛋白酪氨酸磷酸酶 (protein tyrosine phosphatases, PTP) 是关键的信号转导调控因子,其功能的异常与代谢障碍、肿瘤、心血管和神经系统疾病等密切相关,也是药物开发的重要靶点。PTP的催化特点是在其活性位点上的半胱氨酸能与酪氨酸磷酸底物之间形成共价中间体。催化位点附近的WPD环中天门冬氨酸在磷酸基团转移过程中先后充当质子供体和受体。在含FERM结构域的PTP亚家族中,除了PTPN21具有WPE环,其他的成员如PTPN3、N4、N13和N14均具有WPD环,因此有报道认为PTPN21是pseudophosphatase,缺乏磷酸酶活性;但同时有多项研究表明PTPN21在细胞内行使生物学功能需要其催化活性。PTPN21主要参与调控细胞骨架相关生理过程,包括细胞粘附、移动和囊泡运输。过往研究表明PTPN21可以通过去磷酸化Septin1维持造血干细胞稳态;在一些急性淋巴细胞白血病(ALL)中也发现PTPN21基因突变,同时也有报导显示PTPN21在膀胱癌等实体肿瘤样本中高表达,但目前对PTPN21的具体工作机制仍然了解较少。

近日,浙江大学医学院附属邵逸夫医院肖浩文课题组和医学院公共卫生学院、附属邵逸夫医院周春课题组在《Science Advances》杂志上发表题为“Structural analysis of PTPN21 reveals a dominant-negative effect of the FERM domain on its phosphatase activity”的研究论文,揭示了PTPN21的结构和调控机制。
PTPN21全长含有1174个氨基酸,主要由N端的FERM 结构域、C端的PTP结构域构成,中间由富含有脯氨酸(Proline)的柔性区域相连(图1)。在该研究中,研究人员首先解析了PTPN21 PTP-Src pY530复合结构,同时利用多种底物进行了磷酸酶酶活测定,证明PTPN21 PTP结构域在体外是具有较弱的磷酸酶活性,对氧化环境敏感。进一步研究发现PTPN21 FERM和PTP结构域存在直接互作,并且FERM可以抑制PTP的活性,在此基础上研究人员通过蛋白质工程的方法结晶并解析了FERM和PTP复合物结构(图1),鉴定了FERM与PTP相互作用的关键氨基酸位点。突变这些位点可以破坏FERM-PTP的互作,在细胞内导致下游ERK磷酸化增强,同时增加了PTPN21与Src的结合。与此相对应的,很多癌症相关的突变位点也定位在FERM与PTP相互作用的界面上。

图1 PTPN21 FERM-PTP复合物结构
通过结构比较和生化分析,研究人员发现,HPV癌蛋白E7(18E7)的CR3结构域与PTPN21 PTP结合的位点与FERM结合位点重叠(图1),但亲和力比FERM要高得多,这表明HPV18E7可以竞争性地抑制FERM-PTP的互作。同时,细胞内数据显示HPV18E7与PTPN21的结合显著提高细胞中HPV18E7的蛋白水平并且促进了细胞的迁移。
此外,在这项工作中研究人员还解析了PTPN21 FERM单独的结构并证明干扰FERM和脂质的互作会影响PTPN21的部分功能。
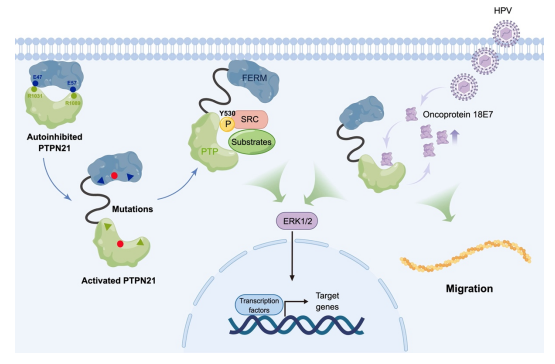
图2 PTPN21部分工作机制
综上所述,本研究表明PTPN21具有较弱的磷酸酶活性,且其活性被FERM-PTP相互作用自抑制,突变引起的FERM和PTP互作减弱会导致PTPN21活性增加和下游ERK激活。当HPV感染细胞时,癌蛋白E7以高亲和力结合PTP,并阻止FERM与PTP结合,使PTPN21处于开放状态以促进ERK信号传导。E7 与PTPN21的结合也导致E7的蛋白质水平升高,从而协同PTPN21促进细胞迁移(图2)。这项工作为理解PTPN21在细胞中的功能提供了一个新的框架,也有助于对其他含FERM的酪氨酸磷酸酶,如PTPN14和PTPN3的研究。
浙江大学医学院附属邵逸夫医院肖浩文教授和浙江大学医学院公共卫生学院、附属邵逸夫医院周春研究员为本文的共同通讯作者。周春课题组博士后陈露、郑郁媛,肖浩文课题组博士研究生钱紫君、技术员张杰为论文的共同第一作者。本文研究还得到浙江大学医学院基础医学院孙洁研究员的合作与协助。

科研办供稿